Calming down the immune system helps Huntington's disease mice
CB2-activating drug improves survival and symptoms in Huntington's disease mice through calming down the immune syste

The immune system is thought to behave abnormally in Huntington’s disease. Now, a drug that activates CB2 receptors on immune cells has been shown to improve symptoms and survival in HD mice – with interesting implications for the immune system as a target for HD therapies.
The immune system in HD
Huntington’s disease is called a neurodegenerative disease, because most of the symptoms are caused by the malfunctioning and death of neurons. But the mutant huntingtin protein that causes HD is produced by every cell in the body, and in recent years, researchers have been looking beyond the brain in the search for HD treatments.
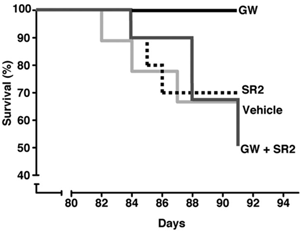
Image credit: Society for Neuroscience (Bouchard et al.)
One discovery that’s arisen from this whole-body approach is that the immune system – our defense against infection and injury – seems to behave slightly differently in HD patients.
On average, levels of immune signaling chemicals called cytokines are higher than normal in people with the Huntington’s disease mutation, even before symptoms begin. And white blood cells from HD patients are hyperactive – when they’re grown in the lab and fired up using chemicals from bacteria, they churn out more cytokines than normal.
The links between the HD gene, the behavior of the immune system and the brain are still being worked out. But there are already signs that artificially altering the immune system might be one way to fight HD.
Last year, a group of researchers led by Dr Paul Muchowski at the Gladstone Institute of Neurological Disease in California showed that altering the chemical behavior of white blood cells, using a drug called JM6, made HD mice live longer. And earlier this year, Muchowski’s team reported that transplanting bone marrow from ‘normal’ mice into HD mice was mildly beneficial.
So, studying the immune system to understand HD, and as a target for possible treatments, is a bit of a hot topic right now. And with a new paper in the Journal of Neuroscience, Muchowski’s team has done it again – this time with a remarkable study centering on the activity of ‘CB2 receptors’ in the immune system.
CB2 receptors?
A receptor is a molecule that sticks out of a cell, waiting for a signalling chemical to reach it. When that happens, the receptor triggers a series of chemical events inside the cell, eventually changing the cell’s behavior.
Each receptor is only capable of ‘catching’ a particular type of signalling chemical, and each receptor causes its own series of events in the cell. That’s how each cell in our body is able to respond appropriately to a variety of signals.
CB2 receptors are part of the ‘cannabinoid’ receptor family. They’re called that because they can be triggered by the chemicals in cannabis. But – just so we’re clear – this isn’t a study of cannabis!
One interesting thing about CB2 receptors is that they are mostly found on cells of the immune system. Activating CB2 receptors ‘calms down’ these immune cells, causing them to produce less of their own signalling chemicals – the cytokines we mentioned earlier.
Knowing this, and knowing that the immune system is overactive in Huntington’s disease, activating CB2 receptors ought to be a good thing. Looking at it the other way round, disabling CB2 receptors might be bad in HD. Muchowski’s team looked at both possibilities, starting with the second one.
Knocking out the CB2 gene
The team started off with a Huntington’s disease model animals called BACHD mice, which produce the human mutant huntingtin protein and develop symptoms similar to HD. Symptoms in BACHD mice begin around six months of age and progress slowly.
They then used genetic engineering to make BACHD mice that don’t have the gene that produces the CB2 receptor. Removing a gene in this way is called a genetic ‘knockout’.
“When the trial was stopped after thirteen weeks, 30% of the untreated mice had died. But none of the GW-treated mice died.”
The BACHD mice with no CB2 receptors developed symptoms much more quickly than normal BACHD mice – at around three months instead of six.
To check that the earlier onset wasn’t just because missing CB2 is bad for brains, Muchowski’s team looked at a third set of mice. These ones lacked CB2 but didn’t produce mutant huntingtin. Those mice seemed normal. It was only when both genetic abnormalities were present – producing mutant huntingtin and missing CB2 – that the mice got very rapidly progressive symptoms.
And it wasn’t just symptoms that were worse in these mice. The researchers looked at the levels of a protein called synaptophysin in their brains. Synaptophysin is essential for the connections between neurons, and there was much less of it in the brains of the BACHD mice that had no CB2 receptors.
Activating CB2 with a drug: GW
With the results of the CB2 knockout suggesting that CB2 receptors are doing something to help keep symptoms at bay in Huntington’s disease, Muchowski’s team took the next step by attempting to increase the activity of CB2 receptors. To do this, they used a CB2-activating drug called GW405833, or GW for short.
To test whether activating CB2 receptors with GW is helpful, the researchers used Huntington’s disease model mice called R6/2 mice. These mice develop symptoms while very young and get sick quickly.
GW was regularly injected into R6/2 mice shortly after the symptoms began, from four weeks of age. Their movement symptoms were tested by measuring their ability to balance. The mice treated with GW did better than untreated mice – they were able to balance on a rotating pole for nearly twice as long.
R6/2 mice usually die after about five months, but GW treatment produced something quite dramatic. When the trial was stopped after thirteen weeks, 30% of the untreated mice had died. But none of the GW-treated mice died. Of course, we don’t know how long they would have lived after the trial, but any way you look at it, this is striking stuff.
Afterwards, Muchowski’s team measured synaptophysin levels in the brain. Recall that these had been lower in the CB2-knockout mice. In GW-treated mice, the synaptophysin levels were higher, suggesting that one beneficial effect of GW is to improve connections between neurons.
With such good results from early treatment, the researchers repeated the trial, starting the treatment a month later at eight weeks of age. By then, the mice were already pretty sick. But the drug was still beneficial for movement problems and brain connections.
Blood or brain?
CB2 receptors are found mostly on immune cells, which in turn are mostly found in the blood, bone marrow and spleen. The brain has its own immune cells, called microglia. So it’s important to ask which cells GW is actually treating. Is it improving symptoms through microglia in the brain, or white blood cells in the body?
Muchowski’s team used a clever trick to find out. Some R6/2 mice were given two drugs. One was GW; the other was a CB2 ‘antagonist’ called SR2. An antagonist is a drug that blocks the activity of a receptor. So SR2 and GW cancel each other out, and it’s as if no drug has been given.
That doesn’t sound terribly clever, until you learn that the drugs reach different places in the body. GW goes everywhere – the blood, the organs and the brain. But SR2 doesn’t reach the brain – it stays in the blood and organs. So because SR2 neutralizes the effect of GW in the body, mice treated with both drugs just get the effects of GW in the brain.

If GW is working in the brain, you’d expect the double-treated animals to improve – but they didn’t. They got sick and died just like untreated mice. That suggests that the benefits of GW are coming about through its effects on immune cells outside the brain.
Something similar had been seen for Muchowski’s other drug, JM6. Together, these results suggest that changing the behavior of the immune system in the body can have beneficial effects for the brain, opening up lots of new lines of attack in the fight against Huntington’s disease.
Going a step further
How might GW working on immune cells benefit the brain? One possibility is through the action of cytokines – those immune signalling molecules we mentioned earlier. Recall that Huntington’s disease patient blood samples have higher levels of these cytokines, particularly one called IL-6.
When Muchowski’s team measured IL-6 levels in the GW-treated mice, they found that they were lower – effectively, the GW had ‘calmed down’ the overactive immune system. So these hard-working scientists carried out another drug trial to investigate IL-6 further.
This time, they gave R6/2 mice injections of an antibody protein that sticks to IL-6 and tells the body to remove it. Mice treated with this IL-6-reducing antibody had better movement control than untreated mice. The effect wasn’t as dramatic as had been seen with GW, but it was there, suggesting that the lowering of IL-6 might be one way that GW’s benefits are reaching the brain.
Summing up
This study, representing years of work, gives us plenty of food for thought.
We already knew that the immune system behaves somewhat differently in HD, but we were less clear as to whether treating it directly was a good idea.
Muchowski’s study provides strong evidence that CB2 receptors are an important link between the immune system in the body, and Huntington’s disease in the brain.
The drug GW produced fairly dramatic benefits for these very sick R6/2 mice, but GW has never been tested in humans, so lots of safety testing will be needed to make sure it’s not harmful. Drugs that activate CB receptors are licensed in some countries (for example, Sativex for symptoms of multiple sclerosis), but there’s no specific CB2 activator on the market.
It’s also worth remembering that other drugs that have improved the R6/2 mouse haven’t so far been successful when tested in humans, because no animal is a perfect model of Huntington’s disease.
One interesting angle from this research is the mild benefit of the IL-6 antibody. Interestingly, such a drug is already licensed for human use in arthritis – it’s called tocilizumab (or Actemra). A human trial of that drug in Huntington’s disease is a possibility, and would likely be quicker to get off the ground than a trial of GW.
Finally – because we know you’re still wondering – this study can’t tell us anything useful about whether cannabis is helpful for Huntington’s disease patients. Though cannabis does contain CB2-activating molecules, it contains hundreds of other chemicals, many of which have other biological effects, that haven’t been tested in HD. So while we know cannabis is popular in HD and beyond, we can’t give it a scientific stamp of approval based on this study.
Learn more
For more information about our disclosure policy see our FAQ…


