Et lægemiddel, som påvirker protein-foldning, hjælper HD-mus...i et stykke tid
Et lægemiddel, der aktiverer en oldgammel forsvarsmekanisme, forsinker HD i mus - men hvorfor varede det ikke ved?
 Skrevet af Professor Ed Wild 28. august 2011 Oversat af Signe Marie Borch Nielsen Redigeret af Dr Jeff Carroll Oprindelig offentliggjort 23. august 2011
Skrevet af Professor Ed Wild 28. august 2011 Oversat af Signe Marie Borch Nielsen Redigeret af Dr Jeff Carroll Oprindelig offentliggjort 23. august 2011
Heat shock-responsen er en forsvarsstrategi, der hjælper proteiner til at holde den rigtige form i tider med stress. Britiske forskere har vist, at aktivering af heat shock-responsen er godt for HD-mus - men effekten varede ikke ved, fordi den blev undermineret af andre virkninger af HD-mutationen. Nu arbejder de på at få effekten til at holde længere.
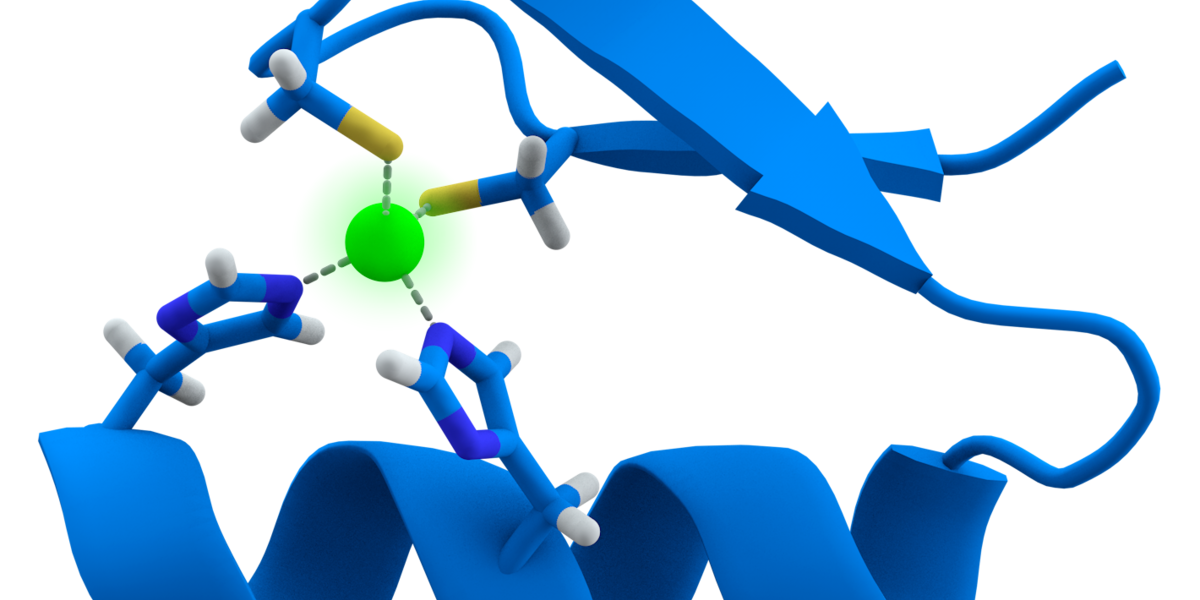
Proteinfoldning og chaperoner
Forestil dig, at du har hundrede skjorter du gerne vil folde pænt sammen. Hvis du smider dem allesammen op i luften, er det helt sikkert, at ingen af skjorterne vil ende med at se ud som du ville have det. Men hvis du lægger en skjorte sammen selv og lægger den i en skuffe, vil den forblive pænt foldet.

Foldning er det samme for proteiner - de molekylære maskiner, der udfører specialiserede opgaver i celler. Når et protein bliver lavet, er det lidt ligesom en række af perler på snor. Det er kun, når denne streng trækkes sammen og foldes i en bestemt form, at proteinet begynder at kunne bruges til noget.
For et protein er formen alt. Det er faconen på et protein, der afgør, hvad det kan og ikke kan gøre. Selv små ændringer i et proteins form kan forhindre det i at fuldføre den opgave, det er der for.
Men ligesom skjorterne folder proteiner sig ikke bare automatisk rigtigt. Celler har et netværk af maskiner der kaldes chaperoneproteiner hvis job det er at sørge for, at andre proteiner får den rigtige form. Chaperoneproteiner kan også folde proteiner pæne igen, efter de er blevet forstyrrede af en eller anden grund.
Det er lidt ligesom en robotmor, der summer omkring i dit soveværelse, og lægger alle dine skjorter pænt sammen.
Foldning inden for Huntington’s chorea
En af de slående ting man ser, hvis man ser i et mikroskop på en hjerne, der er ramt af Huntington’s chorea, er klumper af protein, der kaldes aggregater. Disse klumper er lavet af flere proteiner, herunder mutant huntingtin protein, der forårsager sygdommen. Aggregaterne er bevis på, at der er et stort problem med proteinfoldning i HD.
Problemet med proteinfoldning i HD er dog ikke begrænset til mutant huntingtin. Mutant huntingtin forårsager udbredt kaos, og forstyrrer foldningen af andre proteiner, og deaktiverer endda de chaperoner, hvis job det er at beskytte proteinerne.
Derfor ender celler med Huntington’s chorea-mutationen med udbredte problemer med proteinfoldning, der gør dem mindre sunde.
At styrke hæren af chaperoner
Naturligvis har Huntington’s chorea-forskere tænkt på, om det kunne være muligt at styrke hæren af chaperoner, der beskytter proteiner imod foldningsproblemer.
Arbejde med celler dyrket i laboratoriet og med bananfluer antyder, at det er muligt. Genetiske manipulationer og eksperimenter med lægemidler der aktiverer chaperoner, har alle vist sig at forbedre sundheden for cellerne i disse modelsystemer.
»Selvom det ikke varede ved, så er succesen i den tidlige fase en fod indenfor en dør, som overhovedet ikke var åben før. «
Det næste skridt er at forsøge at øge chaperonefunktionen i et pattedyr med en mere kompleks hjerne. Det er hvad professor Gill Bates og hendes team på Kings College i London gjorde, og resultaterne er netop blevet offentliggjort i Journal of Clinical Investigation.
Heat shock-responsen
I stedet for kun at gå målrettet efter et chaperoneprotein, så antog Bates’ team, at Huntington’s chorea medfører omfattende foldningsproblemer, så en tilgang der aktiverer mange chaperoner burde kunne blive en succes.
Faktisk er vores celler udstyret med en særlig ‘forsvarsindstilling’, som de kan aktivere, når de bliver truet. Den hedder en heat shock-respons, fordi den først blev opdaget i celler, der blev udsat for stærk varme. Men stress eller mange andre slags farer kan aktivere heat shock-responsen. Når den er aktiveret, bliver der ‘tændt’ for nogle gener, der fortæller cellen, at den skal producere mere af flere forskellige slags chaperoner, som bidrager til at stabilisere og reparere proteiner.
Heat shock-responsen kontrolleres af HSF1. HSF1 er en transkriptionsfaktor - det er et protein, der styrer, hvor aktive bestemte gener er. Et gen udgør et sæt instruktioner i, hvordan et bestemt protein laves, og jo mere et gen aktiveres, jo mere producerer cellen af det tilsvarende protein.
Det fungerede…i begyndelsen
Bates’ team brugte et stof kaldet HSP990 til at stimulere HSF1 og aktivere heat shock-responsen i HD modelmus.
I starten var resultaterne ret opmuntrende. HD-mus bliver gradvist dårligere til at kontrollere deres bevægelser, sammenlignet med mus der ikke har et unormalt HD-gen. Efter fire ugers behandling med stoffet havde de behandlede HD-mus det stadig værre end raske mus, men de bevægede sig bedre end HD-mus, der ikke havde fået medicinen.
Målinger af niveauerne af mutant huntingtin protein og chaperoneproteiner i hjernerne af de behandlede mus viste også alle de rigtige ting - chaperonerne var blevet aktiveret, og der var mindre mutant huntingtin ophobet i cellerne.
Senere så det dog ud til, at virkningen af midlet begyndte at mindskes, selvom musene stadig blev behandlet med det. Otte uger inde i behandlingen klarede de behandlede mus sig ikke længere bedre end de ubehandlede mus. Mængden af mutant protein var også steget igen.
Hvorfor holdt midlet op med at virke?

Konstateringen af, at fordelene ved stoffet forsvandt var selvfølgelig skuffende - men det faktum, at det bremsede udviklingen af symptomer i det hele taget var absolut bedre end ingenting.
Videnskaben giver ikke op - hvert tilbageslag eller uventede resultat giver nye oplysninger, som forskerne kan bruge til at lære mere og udvikle nye tilgange til behandling.
Så Bates’ team gik i gang med at forsøge at regne ud, hvorfor stoffet var holdt op med at virke. Og det de opdagede har givet os ny indsigt i, hvordan Huntington’s chorea forårsager skade inde i cellerne.
Forskerne så meget nøje på forholdet mellem lægemidlet (HSP990), proteinet der styrer heat shock-responsen (HSF1), niveauerne af chaperoneproteiner og DNA i cellerne.
De fandt, at der var sket kemiske ændringer i celler med HD-mutationen, som gjorde det sværere for HSF1 at interagere med DNA'et for at aktivere heat shock-responsen.
Med andre ord giver HD-mutationen ikke kun problemer med chaperoneproteiner og proteinfoldning - det gør det også sværere for celler at aktivere deres nødforsvar. Det forklarer, hvorfor stoffet - som forsøgte at udløse en heat shock-respons - gradvist blev mindre i stand til at hjælpe musene.
Hvad nu?
Bates beskriver de første opmuntrende resultater med det chaperone-fremmende lægemiddel som værende “et vigtigt bevis af teorien” om at aktivering af en heat shock-respons kunne være gavnlig i HD - og vi er tilbøjelige til at være enige. Selvom det ikke varede ved, så er succesen i den tidlige fase en fod indenfor en dør, som overhovedet ikke var åben før.
Én konklusion der er blevet draget på baggrund af dette arbejde er, at virkningerne af Huntington’s chorea-mutationen er så omfattende, at der kan være sket for meget skade til at et enkelt stof vil kunne hjælpe, hvis behandlingen startes for sent.
Vi har sandsynligvis ikke tilstrækkelig information til at konkludere dette endnu - selv om de fleste HD-forskere vil være enige i, at tidlig behandling nok vil være bedst, når vi får medicin, der virker.
Indtil da arbejder flere hold af forskere sammen om at afdække de måder, hvorpå HD-mutationen giver problemer med proteinfoldning og chaperoner - og om at udvikle og teste bedre lægemidler til at hjælpe cellerne med at forblive sunde i længere tid.