Forårsager et 'rustent hængsel' Huntingtons sygdom?
Canadiske forskere har fundet ud af, at det mutante huntingtinprotein er mindre fleksibelt end normalt
 Skrevet af Professor Ed Wild 5. september 2013 Redigeret af Dr Jeff Carroll Oversat af Rasmus Siersbæk Oprindelig offentliggjort 27. august 2013
Skrevet af Professor Ed Wild 5. september 2013 Redigeret af Dr Jeff Carroll Oversat af Rasmus Siersbæk Oprindelig offentliggjort 27. august 2013
At finde ud af, hvordan det mutante huntingtinprotein forårsager skade er det centrale spørgsmål, der forsøges besvaret ved forskning i Huntingtons Sygdom. Nu har et hold af canadiske forskere ledet af Dr Ray Truant vist, at proteinet har en vigtig ‘hængsel’-funktion, der virker dårligere i celler med HS-mutationen. Spændende sager, men i modsætning til, hvad du måske har læst, så betyder det ikke, at vi ikke behøver at undersøge mus mere!
Huntingtin
En stor fordel for forskere, der studerer Huntingtons Sygdom, er, at vi ved præcis, hvad der forårsager den i modsætning til mange andre hjernesygdomme. En mutation i et enkelt gen fortæller cellerne, at de skal lave et skadeligt protein: mutant huntingtin. Det er mutant huntingtin, der beskadiger neuroner og andre celler og derved forårsager symptomerne på HS.
I de 20 år, der er gået siden dets opdagelse, har vi fundet ud af en masse om, hvad huntingtinproteinet normalt gør, og hvad der går galt, når dets skadelige tvilling, mutant huntingtin, bliver lavet.
At studere huntingtin er afgørende for vores bestræbelser på at udvikle behandlinger for HS, da det at finde ud af hvordan og hvorfor mutant huntingtin forårsager skade er et vigtigt skridt imod at forhinde den skade.
For mange glutaminer
Proteiner er lavet af lange strenge af byggesten, der hedder aminosyrer. Disse er forbundet ligesom en snor af perler, og den præcise rækkefølge af aminosyrer afgør formen og adfærden af proteinet.
En lille ændring i rækkefølgen af aminosyrer kan forårsage en stor ændring i proteinets form, og det kan ændre dramatisk på, hvordan det udfører sit arbejde i cellerne og endda gøre det giftigt.
Mutant huntingtin er forskelligt fra det ‘normale’ protein på én enkelt måde: i begyndelsen af strengen har huntingtinproteinet en sekvens, hvor én byggesten, glutamin, er gentaget mange gange. Det normale antal glutaminer er mellem ti og tyve.
Huntingtons Sygdom forekommer, når der er for mange glutaminer.
Hvad er det magiske antal?
Så hvor mange glutaminer skal der til før huntingtinproteinet begynder at gøre skade? Sjovt nok er svaret syv-og-tredive. Under dette forårsager huntingtinproteinet ikke Huntingtons Sygdom så vidt vi ved. Over dette er HS uundgåelig så længe en person lever længe nok.
Hvordan i alverden kan det være, at tingene ændrer sig ved 37 glutaminer? Vi ved det ikke! Men at opklare dette mysterium er en top-prioritet for HS-forskere.
Endnu mere mærkeligt er det, at mens de fleste mennesker med Huntingtons Sygdom har mellem 40 og 60 glutaminer, så forårsager dette antal ekstra glutaminer ikke sygdom i andre dyr, inklusiv mus. Dyremodeller for HS skal have over hundrede glutaminer i deres huntingtinprotein før vi begynder at se symptomer.
Dette er endnu et mysterium, og et der antyder, at huntingtin forårsager diskrete, men meget vigtige kemiske problemer i mennesker som ikke kan detekteres i vores dyremodeller.
Hvad med CAG?
»Humane celler kunne bruges til at identificere medikamenter, der hjælper hængslet med at virke, men de mangler stadig at blive testet i dyr, inklusiv mus «
Hvor kommer disse ekstra glutaminer fra, spørger du måske. Svaret ligger i HS-genet, som er en opskrift eller et sæt instruktioner til at lave huntingtinproteinet. Ligesom proteinet har masser af glutaminer i begyndelsen, har genet også et stykke, hvor de kemiske ‘bogstaver’ C-A-G er gentaget. Antallet af ‘CAG’-gentagelser i genet svarer til antallet af glutaminbyggesten i proteinet. Og hvis der er for mange CAG'er i genet, vil der være for mange glutaminer i huntingtinproteinet.
Så hvad er nyt?
Professor Ray Truant, hans studerende Nick Caron og Truants hold ved McMaster Universitetet i Canada har netop publiceret en artikel i tidsskriftet PNAS, der beskriver deres studie af, hvordan antallet af glutaminer påvirker huntingtinproteinet. For første gang har de fundet en potentielt vigtig ændring, der sker omkring det kritiske antal på 37 glutaminer.
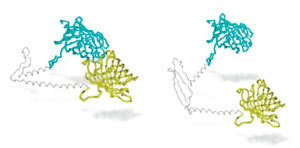
Proteinstykkerne på hver sin side af alle disse glutaminer er små stykker kaldet ‘opstrøms’ og ‘nedstrøms’ regioner. Tidligere forskning har indikeret, at hver af disse spiller en rolle for at give det mutante protein dets skadelige egenskaber.
Hvad Truant’s hold gjorde var at spørge, om opstrøms- og nedstrøms-regionerne i virkeligheden arbejder sammen, med glutamin-stykket imellem virkende som et hængsel. De spekulerede også over om dette ‘hængsel’ mon virkede korrekt i det mutante protein.
Tid til en Ringenes Herre-analogi
For at undersøge dette blev de nødt til at finde ud af om opstrøms- og nedstrøms-regionerne ender op med at være tæt nok på hinanden til at arbejde sammen. De brugte en smart slags ‘nærheds-sensor’ kaldet FLIM-FRET.
Kan du huske Frodos sværd ‘Sting’ i Ringenes Herre-filmene, og hvordan det lyste blåt, når orker var i nærheden? FLIM-FRET er lidt ligesom det.
Forskerne satte specielle lys-sensitive vedhæftninger på huntingtinproteinet, én på opstrømsregionen og én på nedstrømsregionen. Disse vedhæftninger gør ingenting med mindre proteinet folder på en sådan måde, at de to regioner bringes sammen. Når dette sker overføres lys fra én vedhæftning til den anden, lyser op (ligesom Frodo’s sværd) og kan måles.
Det rustne hængsel i HS
Truants Sting-lignende nærheds-sensor beviste, at opstrøms- og nedstrøms-regionerne faktisk ender op med at være foldet tæt på hinanden i celler - med glutamin-stykket virkende som et hængsel. Desuden lyste det mindre klart, når der var 37 eller flere glutaminer i huntingtinproteinet, hvilket indikerer, at problemerne med hængslet begynder omkring dette antal. Truant kalder dette den ‘rustne hængsel hypotese’ og foreslår, at dette er én måde, hvorpå det mutante protein kan forårsage skade.
Truant’s hold bekræftede disse resultater ved at bruge proteiner af flere forskellige længder og også vise den samme abnormalitet i hudceller taget direkte fra en patient med Huntingtons Sygdom.
Bind enderne sammen

Hvordan passer denne ‘rustne hængsel’-ide med andre ting vi allerede ved om mutant huntingtin?
Ja, vi ved, at et andet protein kaldet PACSIN kan klistre til huntingtins nedstrømsregion. Her viste Truants hold, at det også kan klistre til opstrømsregionen, hvilket indikerer, at det måske kan holde de to regioner sammen på tværs af glutamin-hængslet - som en lukkemekanisme.
Når PACSIN blev kunstigt fjernet lyste nærheds-sensoren mindre, hvilket indikerer, at opstrøms- og nedstrøms-regionerne var sprunget fra hinanden. Ved at ændre adfærden af PACSIN kunne dette hængselproblem løses - en mulig ny tilgang til at tænke på behandling af Huntingtons Sygdom.
Den anden forbindelse til vores eksisterende forståelse kommer fra små kemiske ændringer som cellerne laver på proteiner. Disse kemiske enheder kan ændre på, hvordan proteiner opfører sig og hvor de ender henne. Truant’s hold havde tidligere vist, at ‘fosfo’-enheder er vigtige for at bestemme, hvor huntingtinproteinet bevæger sig hen og hvor skadeligt det er.
I deres seneste arbejde demonstrerede de, at disse fosfo-enheder også kan have en effekt på aktiviteten af glutaminhængslet. Dette underbygger idéen om, at medikamenter til at kontrollere påsætning af fosfo-enheder måske er i stand til at forebygge nogle af de skadelige effekter af det mutante protein.
Hvad denne forskning viser
Truants hold har udført et rigtig godt stykke arbejde, hvor de har opfundet en nærheds-sensor (eller lånt en af Frodo Baggins)og brugt den til at vise, at huntingtins vigtige glutamin-region - den del, der er for lang i HS - fungerer som et hængsel, der tillader opstrøms- og nedstrøms-regionerne at arbejde sammen.
Alt imens et andet protein, PACSIN, strækker sig over hængslet og trækker dem sammen. Og de har forbundet hængsel-funktionen med påsætningen af fosfo-enheder til huntingtin. Hvad mere er, denne hængsel-egenskab ser ud til at stoppe med at virke ved ca det samme antal glutaminer, som forårsager sygdom i patienter.
Dette er ikke bare ny information omkring huntingtinproteinet og hvordan det forårsager skade. Det giver os også nye idéer til mulige behandlinger - ved at ændre adfærden af PACSIN1 eller det maskineri, der kontrollerer påsætningen af fosfo-enheder.
Hvad den ikke viser
Dette ville ikke være en HDBuzz-artikel uden nogle forbehold. I dette tilfælde synes vi, at det er vigtigt at fremhæve nogle af de ting denne forskning ikke fortæller os - i modsætning til, hvad du måske har læst online.
CBS news har rapporteret, at dette arbejde “omgår behovet for museforsøg”, da Truant’s resultater kunne ses i humane celler. Desværre er dette ikke rigtigt. Humane celler kunne bruges til hurtigt at identificere medikamenter, der hjælper ‘hængslet’ med at virke bedre, men sådanne medikamenter vil stadig skulle testes i dyr, inklusiv mus. For at besejre HS har vi brug for al den hjælp, vi kan få. Ingen enkel dyremodel er perfekt til at udvikle medikamenter - men det er humane celler, der gror i en skål og endda patienter i sig selv heller ikke. Forskellige modelsystemer kan hver især bidrage med nyttig information til at hjælpe os med at gøre fremskridt.
Desuden giver dette arbejde os ikke en komplet forståelse af, hvordan hængsel-problemet får huntingtinproteinet til at blive skadeligt. Ofte er det sådan i forskning, at bag hver dør finder vi en anden dør, som kræver mere arbejde at åbne. Truants hold og andre vil nu arbejde på at få et overblik over, hvordan huntingtins hængsel-problem kan påvirke den måde cellerne og hjernen virker på. Og at omdanne disse resultater til behandlinger, der kan benyttes af patienter, vil kræve endnu mere arbejde. Så vi fortsætter!