Dobbelt succes for RNAi-genhæmning af huntingtin
2 gode nyheder for RNAi-genhæmning i HS: Det er sikkert i over 6 måneder, og en måde at behandle større hjerneområder
 Skrevet af Professor Ed Wild 31. januar 2012 Oversat af Signe Marie Borch Nielsen Redigeret af Dr Jeff Carroll Oprindelig offentliggjort 24. januar 2012
Skrevet af Professor Ed Wild 31. januar 2012 Oversat af Signe Marie Borch Nielsen Redigeret af Dr Jeff Carroll Oprindelig offentliggjort 24. januar 2012
De fleste HS-forskere er ret optimistiske omkring ideen at ‘hæmme’ genet for Huntingtons Sygdom, for at nedsætte produktionen af det skadelige huntingtinprotein. To udfordringer - sikkerhed og levering - er begge tættere på at blive løst takket være samarbejde mellem forskere fra industrien og universiteterne.
Vi er store fans af genhæmning. Som mange andre forskere indenfor Huntingtons Sygdom (HS) mener vi, at det er den tilgang, som mest sandsynligt vil føre til en effektiv behandling af HS.
Genhæmning (på engelsk gene silencing) indebærer anvendelse af et specielt designet stof til at opsnappe et beskedmolekyle, kaldet RNA, der fremstilles ud fra HS-genet, og giver cellen besked på at fremstille det skadelige huntingtinprotein. Stoffet virker derfor på den måde, at cellerne laver mindre huntingtinprotein.
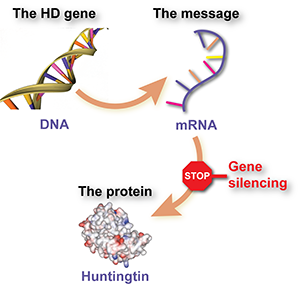
Sagt endnu enklere - genhæmning er lidt som et stopskilt for mutant huntingtin.
Hurtige fremskridt
Hidtil har genhæmning af HS, i forskellige former, fjernet en hver forhindring det er stødt på. Det er nu blevet testet i flere HS-muse- og -rottemodeller, og har ikke kun bremset sygdomsudviklingen, men har rent faktisk givet forbedring af både symptomer og skader på hjernen. Det ser ud til, at hjernen faktisk kan komme sig - til en vis grad - hvis blot niveauet af det skadelig protein kan sænkes en smule.
De resterende forhindringer
Adskillige forskerhold er på vej med humane forsøg med genhæmning i HS. Men der er et par udfordringer, der endnu skal løses, før det kan ske.
Den første er sikkerhed. Uventede bivirkninger kan altid opstå, og kan være alvorlige, da vi taler om stoffer, der injiceres eller infunderes direkte i nervesystemet, og interagerer direkte med vores cellers genetiske maskiner.
En anden er levering. Genhæmningsmedicin kan ikke gives som piller eller injektioner i blodet, fordi de ikke ville blive lukket ind i hjernen. Så de er nødt til at blive indført direkte i nervesystemet. Afhængig af stoffets struktur, betyder det en operation for at indføre nåle eller rør i enten rygsøjlen eller kraniet. Det lyder drastisk, men hvis behandlingen er effektiv, vil det være det værd.
Leveringsproblemet stopper dog ikke der, for selv når stoffet når ind i hovedet, skal det stadig ind i vores hjerneceller for at kunne udføre sine genetiske tryllekunster.
Genhæmningsmenuen
Genhæmningsforskerne er nødt til at træffe adskillige valg, før de begynder et behandlingsstudie. Her er en tjekliste til at hjælpe dig med at forstå fremtidige nyheder.
Først er vi nødt til at beslutte, hvordan lægemidlets struktur skal være. De to grundlæggende muligheder er RNAi-stoffer, der kemisk ligner kroppens RNA-budskabsmolekyler, og ASO-stoffer, som er lidt anderledes, men måske absorberes bedre af cellerne.
Det andet valg, der skal træffes, er hvad mål man skal vælge; begge kopier af HS-genet, eller bare den mutante. At målrette stoffet mod begge - kaldet uspecifik hæmning - er nemmere, men at slukke det ‘normale’ gen kan være farligt. At gå målrettet efter det muterede gen - kaldet allel-specifik hæmning - kan være sikrere, men er meget sværere.
Det tredje valg er destinationen - hvor skal stoffet hen? RNAi-lægemidler spredes ikke særligt langt af sig selv, så stoffet er nødt til at blive leveret lige ind i hjernen. Midler, der spreder sig bedre, såsom ASO'er, kan infunderes i væsken omkring hjernen, eller hvis vi er heldige, ved basen af rygsøjlen.
Det fjerde valg vi skal tage angår levering. Skal medicinen gives alene, pakket i en virus eller pumpes ind under tryk, for at øge dens udbredelse gennem hjernen?
Den femte valg handler om behandlingsregimet. Skal vi give en engangsbehandling eller indføre stof i løbet af uger eller måneder? Lige nu ved vi ikke, hvor længe effekten vil vare, så dette skal afgøres ved at sammenligne forskellige behandlingsmuligheder.
Når du læser om genhæmningsforskning, er det nyttigt at starte med at finde ud af, hvilken mulighed der er blevet valgt for hver af disse punkter.
Tre på én gang
På den seneste HS-verdenskongres i Melbourne rapporterede HDBuzz om spændende oplæg fra flere genhæmningsforskergrupper. Og i november bragte vi dig nyheder om det første sikkerhedsstudie af huntingtin-genhæmning med RNAi i en primathjerne.
»Målinger viste, at RNAi-stoffet spredte sig langt mere, end man ville forvente ved almindelige injektioner. Meget mere, faktisk. «
Nu er yderligere to videnskabelige artikler blevet offentliggjort - hver af disse er frugten af et samarbejde mellem akademiske forskere og bioteknologiske virksomheder. Både virksomheden Medtronic fra Minneapolis, USA og Dr. Zheming Zhangs forskergruppe fra University of Kentucky er involveret i begge artikler.
Seks måneders sikkerhed
Artiklen fra november om hvor sikkert RNAi er i primater, omhandlede en ganske kort undersøgelse - kun seks uger. Den nye undersøgelse af Medtronic og Zhangs gruppe, som blev offentliggjort i tidsskriftet Brain, blev også lavet i rhesus-aber, men varede hele seks måneder.
Lad os se på hvad forskerne undersøgte ved hjælp af tjeklisten ovenfor:
Struktur: Dette var et forsøg med et RNAi-stof.
Mål: Begge kopier af genet blev påvirket - altså uspecifik genhæmning.
Destination: Hjernevævet - striatum, for at være helt nøjagtig, som rammes tidligt i HS-patienter.
Levering: Stoffet var pakket ind i en tom virus, kaldet AAV2.
Behandlingsforløb: En enkelt indsprøjtning fem forskellige steder på hver side af hjernen
Det er også værd at bemærke, at der blev brugt ‘normale’ aber i studiet, som ikke havde nogle udvidede kopier af HS-genet. Så dette forsøg kunne kun måle ændringer i proteinmængden og sikkerhed - det kan ikke forudsige eventuelle forbedringer i patienter.
Efter behandlingen blev aberne observeret i seks måneder, hvor deres generelle sundhed og bevægelseskontrol blev overvåget. Dyrene klarede operationen godt, og man så ingen nye problemer i de behandlede dyr.
Som håbet, faldt niveauet af huntingtinprotein betydeligt i de behandlede områder. På hvert injektionssted blev proteinniveauet reduceret over et areal cirka seks millimeter på tværs - det er et område, som udgør omkring tre M&Ms pr. hjerne. Det lyder måske ikke af meget, men i en menneskelig hjerne kunne det gøre en stor forskel, og det er også værd at huske, at disse målinger blev foretaget 6 måneder efter en enkelt behandling.
Heldigvis medførte behandlingen med stoffet ingen skadelige ændringer i hjernen såsom betændelse, infektion eller skader på neuronerne.
Så stoffet gjorde sit arbejde og reducerede proteinniveauet, og behandlingen syntes ikke at have nogen skadelige virkninger. Forfatterne regner med, at seks abemåneder svarer til omkring 18 menneskemåneder. Det lyder godt - men som forfatterne påpeger, kan det tage endnu længere tid hos mennesker, før gode eller dårlige virkninger dukker op.
En innovativ leveringsmetode
Den anden nye artikel kom fra et tre-partssamarbejde mellem gruppen fra University of Kentucky, Medtronic, og RNAi-medicinalfirmaet Alnylam Pharmaceuticals. Det blev offentliggjort i tidsskriftet Experimental Neurology.
Dette var også en undersøgelse af ikke-specifik genhæmnings-RNAi leveret i striatum på aber.
Det, der adskiller dette arbejde fra det andet, er den innovative leveringsmetode. Her blev der brugt en teknik, der kaldes konvektionsforbedret levering (CED). Dette indebærer, at et rør føres gennem kraniet og ind i hjernevævet. Den øverste ende af røret bliver tilsluttet til en lille pumpe, der konstant sprøjter stoffet ned i røret under tryk. Dette tryk er vigtigt - det gør at stoffet spreder sig meget længere, end det ellers ville.

CED bliver allerede brugt til at få kemoterapimedicin til at sprede sig yderligere inden i hjernetumorer. Men ville det kunne bruges til at levere et RNAi-stof?
Først blev lægemidlet pumpet ind i hjernen i syv dage. Kun den ene side af hjernen blev behandlet, så den anden kunne bruges som kontrol til sammenligning med den behandlede del. En række doser og infusionshastigheder blev forsøgt for at finde den bedste kombination. Derefter blev en 28-dages-infusion afprøvet. Forskerholdet lavede smarte, men harmløse radioaktive ændringer i stoffet, som satte dem i stand til at måle præcist, hvor langt det havde spredt sig.
Stoffet virkede som det skulle, og reducerede huntingtinniveauet, og rørene og infusionerne gjorde ikke nogen særlig skade på hjernen.
Men var det yderligere besvær med montering af rør og pumper det værd - fik det stoffet til at spredes yderligere? Kort sagt, ja.
Målinger viste, at RNAi-stoffet spredte sig langt mere, end man ville forvente ved almindelige injektioner. Hvis begge sider af hjernen var blevet behandlet, ville huntingtinniveauet være blevet reduceret i et område af hjernen svarende til omkring elleve M&M’s.
Kort sagt…
Før disse to artikler blev offentliggjort, vidste vi allerede, at huntingtin kunne sænkes i abehjernen ved hjælp af RNAi. Nu kan vi krydse endnu to store punkter af på vores ønske-liste: For det første virker genhæmning, og det er sikkert over længere perioder, og for det andet findes der måder at få stoffet til at sprede sig yderligere.
Hvad kan der gå galt?
Forsigtig optimisme er en klog tilgang her. Der er bestemt nogle ting, der kunne gå galt på vejen til forsøg i mennesker, eller under dem.
Disse primatforsøg har vist, at sænkning af huntingtinniveauet er sikkert i raske aber. Men det betyder ikke, at det er helt sikkert i menneskelige patienter. Menneskehjernen er langt større og mere kompleks end abehjernen. Så behandling kan være mindre effektiv, eller mere farlig, simpelthen på grund af artsforskelle.
Det er også muligt, at det sunde protein på en eller anden måde beskytter hjernen mod dets skadelige bror i mennesker. Hvis det er tilfældet, kunne hæmning af begge kopier gøre uventet mere skade end gavn.
Hjernen hos mennesker med HS-symptomer er sandsynligvis også mere skrøbelig og vanskelig at operere på. De dele af hjernen, der har brug for behandling, er mindre end normalt, på grund af svind forårsaget af HS. Så operationer kan være sværere og mere risikable.
Endelig kan det være svært at måle, om behandlingen rent faktisk virker i mennesker, fordi sygdommen udvikler sig langsomt, og vi ikke kan undersøge patientens hjerne under lup.
Men man må aldrig glemme, at nogle af de bedste videnskabelige hjerner i verden arbejder sammen for at løse disse problemer, og at de alle fokuserer på at gøre effektive behandlinger til virkelighed for patienterne.
2012 - året for genhæmning i HS?
Kunne 2012 være året for genhæmning til HS-patienter? Vil vi se et eller flere forsøg med mennesker i de kommende måneder? At dømme efter de hidtidige fremskridt, tror vi rent faktisk at det er en fornuftig ting at håbe på, og flere grupper arbejder hårdt på at gøre det til en realitet. De første forsøg vil være små, og vil blive udført langsomt og med stor forsigtighed, fordi sikkerheden er den primære bekymring. Men hvis alt går vel, vil større forsøg følge.